近日,海思科创新药研发迎新进展,HSK16149胶囊申报上市、HSK31858片Ⅱ期临床试验获伦理批准。目前海思科有16个创新药(13个1类新药)在研,3款1类新药上市可期;麻醉新药快速放量,License-in/out交易并行;23个品种过评(11个为国内首家),8个品种中标国家集采,3个新分类报产品种在审。
13款1类新药在研,瞄准3大千亿市场
11月8日,海思科发布公告称,1类新药HSK16149胶囊上市申请获国家药监局受理,拟用于周围性神经病理性疼痛的治疗。11月16日,海思科发布公告称,1类新药HSK31858片Ⅱ期临床试验获得伦理批准,拟用于治疗支气管扩张症及急性肺损伤/急性呼吸窘迫综合征引起的下呼吸道疾病。
海思科以创新药研发、生产、销售为核心业务,致力于成为最受信赖的国际化创新药企业。2022年上半年海思科研发投入3.47亿元,同比增长1.52%,研发投入占销售收入的比重为27.82%。
目前海思科在研创新药有16个(含1类13个、2类3个),聚焦于麻醉及镇痛、糖尿病及并发症、神经痛以及肿瘤等疾病领域。米内网数据显示,2021年中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端抗肿瘤和免疫调节剂、消化系统及代谢药销售规模均超过1700亿元,神经系统药物销售规模超过1000亿元.
海思科主要创新药情况
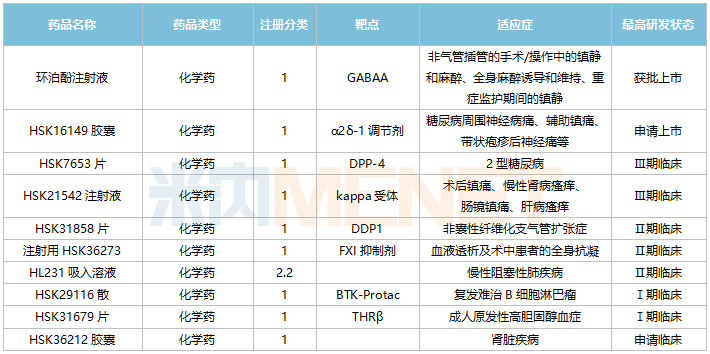
来源:米内网中国临床试验库、公司公告
公司创新研发管线逐步进入兑现期,目前α2δ-1调节剂HSK16149胶囊已申报上市;DPP-4抑制剂HSK7653片、kappa受体HSK21542注射液均处于Ⅲ期临床阶段;DPP1抑制剂HSK31858片、FXI抑制剂注射用HSK36273、HL231吸入溶液均处于Ⅱ期临床阶段。
3款1类新药上市可期!HSK16149胶囊可以与钙离子通道α2δ亚受体结合,首个申报上市的适应症为糖尿病周围神经痛,带状疱疹后神经痛适应症处于Ⅲ期临床阶段。HSK7653是一款DPP-4长效抑制剂,计划于2022年底申报NDA,有望成为全球首款降糖药双周制剂。HSK21542注射液是镇痛加止痒双重作用的外周kappa阿片受体选择性激动剂,是公司首个国际化的fast follow新药,开发适应症包括术后镇痛、尿毒症瘙痒、肝病瘙痒等。
环泊酚销售额暴涨!拿下4笔License-in/out交易
环泊酚注射液是海思科首个进入商业化阶段的1类新药,也是麻醉领域重磅创新药,2021年11月获纳入2021版国家医保目录。以获批上市作为“起点”,环泊酚注射液适应症持续拓展、国际化稳步推进,目前在国内已获批非气管插管的手术/操作中的镇静和麻醉、全身麻醉诱导和维持、重症监护期间的镇静等适应症;在美国直接开展Ⅲ期临床研究,预计于2023年底申报上市。
适应症拓展与医保助力下,环泊酚注射液市场迎来快速放量。财报显示,2022年上半年环泊酚销售数量约150万支,已进入900多家医院,其中三甲以上医院占比达55%;力争全年目标医院覆盖达到1400家左右,全年实现环泊酚销售数量达400万支以上。令人瞩目的是,上半年公司麻醉产品销售额实现1.29亿元,同比增长1602.52%。
除了自研产品的国际化,海思科还积极加强商务发展,自2021年开始加速推动研发项目License-out和License-in,优化商业合作充盈产品管线。
License-out方面,海思科海外控股子公司FTP-637项目出售给Foresite Capital,获得6000万美元首付款和最高1.2亿美元的里程碑付款,彰显公司研发实力与产品国际化潜力。FTP-637是一款TYK2抑制剂,全球首款TYK2抑制剂于2022年9月获FDA批准上市,为百时美施贵宝的氘可来昔替尼。
License-in方面,海思科先后引进美国Starton用于肿瘤化疗所致呕吐的奥氮平透皮贴剂、美国Biosplice长效治疗骨关节炎的Lorecivivint、美国Aquestive治疗“渐冻症”的利鲁唑口腔膜。
目前全球暂无奥氮平透皮贴剂获批上市。米内网数据显示,2021年中国公立医疗机构终端奥氮平销售规模超过20亿元,同比增长6.63%;2022年上半年其销售规模超过10亿元,同比下滑9.66%。利鲁唑是FDA批准的第一个渐冻症药物,2021年在中国公立医疗机构终端销售规模超过1亿元,国内已上市制剂包括利鲁唑片、利鲁唑胶囊、利鲁唑口服混悬液。
23个品种过评,仿制药管线“收缩”?
仿制药方面,海思科累计已有22个首仿药获批上市。随着公司向创新药转型,仿制药在研产品逐步减少。2022年至今海思科只提交了格列齐特缓释片一款仿制药的上市申请,于7月5日获CDE承办。
公司仅剩3个新注册分类仿制药上市申请在审,具体为利丙双卡因乳膏、复方维生素注射液、格列齐特缓释片,获批生产后将视同通过一致性评价。随着仿制药品种数量不再新增、存量品种集采消化完毕,公司仿制药业务将进入稳定发展状态。
目前,海思科已有23个品种通过/视同通过一致性评价。其中,11个品种为国内首家过评,聚普瑞锌颗粒、复方氨基酸注射液(18AA-Ⅶ)、复方氨基酸(18AA)/葡萄糖(15%)电解质注射液等3个品种为独家过评。
海思科通过/视同通过一致性评价品种
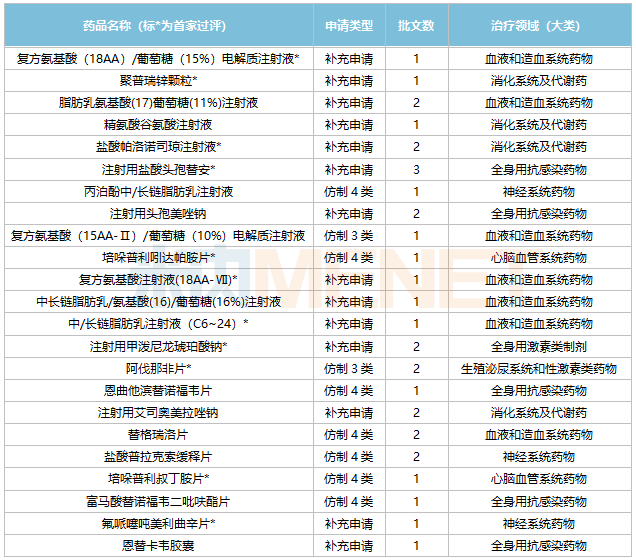
来源:米内网中国申报进度(MED)数据库
从治疗领域上看,23个品种主要集中在血液和造血系统药物(7个)、全身用抗感染药物(5个)。米内网数据显示,2021年中国公立医疗机构终端血液和造血系统药物、全身用抗感染药物销售规模均超过1500亿元。
在国家开展的第三、第四批集采中,海思科各有3个品种中标,第七批集采则有2个品种中标,累计8个品种中标国家集采。其中,5个品种以一致性评价补充申请过评,3个品种以新分类注册批产并视同过评。
一致性评价补充申请方面,海思科还有6个品种在审,包括复方氨基酸注射液(20AA)、注射用醋酸卡泊芬净、复方氨基酸注射液(18AA-Ⅸ)、磺达肝癸钠注射液、富马酸卢帕他定片、复方氨基酸注射液(18AA-Ⅶ)。其中,富马酸卢帕他定片、复方氨基酸注射液(18AA-IX)冲刺首家过评。
数据来源:米内网数据库、公司公告注:米内网《中国公立医疗机构药品终端竞争格局》,统计范围是:中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院,不含民营医院、私人诊所、村卫生室;上述销售额以产品在终端的平均零售价计算。
来源:米内网









